Щелочноземельные металлы
Составитель: учитель МОКУ «Китаевская СОШ»
Трубинова Е.Л.

- Обобщить и системати-зировать знания о щелочноземельных металлах
- Уметь характеризовать элементы по положению в периодической таблице
- Знать физические и хими-ческие свойства
- Знать применение соеди-нений щелочноземельных металлов

Положение в периодической системе. Строение атома
Щелочноземельные металлы в периодической системе находятся в главной подгруппе II группы.
Являются сильными восстановителями, отдают 2 ē , во всех соединениях проявляют степень окисления +2.
Mg +12 2 ē , 8 ē , 2 ē
Ca +20 2 ē , 8 ē , 8 ē , 2 ē
Sr +38 2 ē , 8 ē , 18 ē , 8 ē , 2 ē
Ba +56 2 ē , 8 ē , 18 ē , 18 ē , 8 ē , 2 ē

Физические свойства
цвет пламени ρ t плавления
1,74г/ см 3 651 С 0
1,54г/ см 3 851 С 0
2,63г/ см 3 770 С 0
3,76г/ см 3 710 С 0

Химические свойства
2Me 0 +O 2 → 2Me +2 O -2
Me 0 +H 2 → Me +2 H 2
Me 0 +Cl 0 2 → Me +2 Cl 2
Me 0 +S 0 → Me +2 S -2
Me 0 +2HCl → Me +2 Cl 2 + H 2
Me 0 +2HOH → Me +2 (OH) 2 + Н 2

Соединения щелочноземельных металлов
Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей.

BaSO 4
Благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.

Ca 3 (PO 4 ) 2
Входит в состав фосфоритов и апатитов, а также в состав костей и зубов. В организме взрослого человека содержится 1 кг Са в виде фосфата кальция.

CaCO 3
Карбонат кальция – одно из самых распространённых на Земле соедине - ний. Его содержат горные породы – мел, мрамор, известняк.

Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строитель - стве, в медицине для наложения гипсовых повя - зок, для получения слепков.
CaSO 4 ∙ 2H 2 O
Встречается в природе в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков.

MgCO 3
Широко применяется в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы в шлак.

Са(ОН) 2
Гидроксид кальция или гашёная известь с песком и водой называется известковым раствором и широко используется в строительстве. При нагревании разлагается на оксид и воду.

Проверка знаний
Сравните атомы элементов, поставив знаки или = вместо *:
а) заряд ядра: Mg * Ca , Na * Mg , Ca * К;
б) число электронных слоев: Mg * Ca , Na * Mg ,
Ca * К;
в) число электронов на внешнем уровне:
Mg * Ca , Na * Mg , Ca * К;
г) радиус атома: Mg * Ca , Na * Mg , Ca * K ;
д) восстановительные свойства: Mg * Ca ,
Na * Mg , Ca * K .

Проверь себя (самостоятельная работа)
Дополните схемы взаимодействия щелочноземельных металлов с неметаллами общими формулами и названиями продуктов реакции.
Запишите конкретные уравнения реакции, расставив коэффициенты в них методом электронного баланса:
а) М + S б) М + N 2
в) М + Н 2 г) М + С1 2
Пример: ___________________ Пример: _____________________
Допишите уравнения реакций:
а) Са + H 2 O → ……………………….
б) Mg + НС l →……………………….
в) Ва + О 2 →………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН) 2 → МеSО 4

Домашнее задание:
§ 12. упр. № 5, 8
Написать уравнения реакций с помощью которых можно осуществить два любых превращения из составленных учащимися на уроке.

Используемая литература
- Рудзитис Г.Е., Фельдман Ф.Г. Химия 9.- Москва.: Просвещение, 2001
- Габриелян О.С. Химия 9.-Москва.:Дрофа,
- Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.-Москва.:Дрофа 2002
- Коллекция Виртуальной лаборатории. Учебное электронное издание
Муниципальное автономное общеобразовательное учреждение
«Средняя школа № 24» г. Сыктывкара
ПЛАН – КОНСПЕКТ УРОКА
ТЕМА: Щелочноземельные металлы
Выполнила: Малахаева Анна Львовна
СЫКТЫВКАР, 2015
Цель урока:
Изучить физические, химические свойства щелочноземельных металлов;
Узнать о применении щелочноземельных металлов и их соединений.
Тип урока - урок освоения нового материала.
Технология критического мышления
Формы организации учебной деятельности – фронтальная, парная, индивидуальная.
Методы обучения :
Ч астично-поисковый;
Межпредметная беседа.
Приемы обучения :
самостоятельная /парная / индивидуальная работа учащихся.
Задачи
I Обучающие:
Описывать физические свойства ЩЗ металлов;
Знакомство с особенностями химических свойств и областями применения ЩЗ металлов.
II Развивающие:
Развитие и обобщение знаний учащихся о практическом использовании ЩЗ металлов;
III Воспитательные :
Оборудование:
Мультимедийный проектор
для демонстрационных опытов: магний, соляная кислота, ложечки для сжигания веществ, спички, склянки заполненные кислородом, пробирки;
инструктивная карточка «Применение ЩЗ металлов и их соединений»
Литература для учителя:
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: 9 класс: Учебник для учащихся общеобразовательных учреждений/ Под ред. Н.Е.Кузнецовой. – М.: Вентана-Граф, 2008.
Шаталов М.А., Кузнецова Н.Е. Обучение химии. Решение интегративных учебных проблем: 8-9 классы: Методическое пособие. – М.: Вентана-Граф, 2006.
Кузнецова Н.Е., Шаталов М.А. Обучение химии на основе межпредметной интеграции: 8-9 кл.: учебно-метод. Пособие. –М.: Вентана –Граф, 2006.
Г.О. Аствацатуров Технология целеполагания урока. – Волгоград: Учитель, 2009.
Материалы мастерской «Разработка компетентностно-ориентированных заданий по учебным предметам» АНО «Центр Развития Молодежи» г. Екатеринбург.
Ход урока
I Организационный момент
Приветствие учителя. Готовность к уроку. Что вы видите на картинки. Что их объединяет? (Слайд 1). Металлы.
II Актуализация знаний
Давайте вспомним все то, что знаем о металлах («Знаю»). Металлы располагаются в нижней левой части ПС, обладают металлическим блеском, хорошо проводят электрический ток, а также изучили свойства щелочных металлов (Слайд 2). А что мы еще не изучили? Предполагают, щелочноземельные металлы и подгруппа алюминия . Итак, какова же тема урока сегодня? Щелочноземельные металлы (Слайд 3). Значит, что мы хотим узнать? Физические свойства, химические свойства и применение (Слайд 4). Целью нашего урока будет: 1. Изучить физические, химические свойства щелочноземельных металлов; 2. Узнать о применении щелочноземельных металлов (Слайд 5).
Физические свойства ЩЗ металлов. Как вы думаете, какими физическими свойствами будут обладать щелочноземельные металлы? Предполагают: металлический блеск, мягкость (по аналогии со щелочными), невысокая плотность. У вас на столах есть инструктивная карточка. Прочитайте текст. Что общего между ними? Имеют серебристый цвет, и все мягкие, кроме бериллия (Слайд 6) .
Что обуславливает химические свойства щелочноземельных металлов? Наличие 2 электронов на внешнем энергетическом уровне. Как вы думаете, с чем будут реагировать щелочноземельные металлы? Могут предположить: с водой, кислотами, кислородом.
Химические свойства ЩЗ металлов.
Давайте рассмотри химические свойства. Для этого разделимся на три группы (по колонкам). Откройте §51 стр.237. I колонка запишет химические свойства с кислородом и с галогеном на примере магния. 2 Me + O 2 = 2 MeO (оксид), 2M g + O 2 = 2M gO . Посмотрим, как сгорает магний (демонстрационный опыт: горение магния (показывает ученик)). Me + Hal 2 = MeHal 2 ( галогениды ), Mg + Cl 2 = MgCl 2 .
II колонка – с серой и с азотом на примере кальция. Me + S = MeS ( сульфид ), Sr + S = SrS; Me + N 2 = Me 2 N 3 ( нитрид ), Sr + N 2 = Sr 2 N 3 . III колонка – с водородом и с водою на примере кальция. Mе + H 2 = MеH 2 (гидрид), Ca + H 2 = Ca H 2 ; Ме + 2Н 2 О = M е(OH ) 2 + H 2 , Ca + 2Н 2 О = Ca (OH ) 2 + H 2 .
Еще ЩЗ металлы будут взаимодействовать с кислотами. Посмотрим, как магний будет взаимодействовать с соляной кислотой (демонстрационный опыт: взаимодействие магния с кислотой (показывает ученик)). Внимание на слайд! Me + кислоты = соль + H 2 (Слайд 7) . Какие продукты образовались в результате реакции? Хлорид магния и выделяется водород. Mg + 2HCl = MgCl 2 + H 2.
Нахождение щелочноземельных металлов в природе и соединения щелочноземельных металлов. Как вы думаете, где в природе можно встретить щелочноземельные металлы в чистом виде? Нигде, т.к. в чистом виде они не встречаются ввиду своей высокой химической активности. У вас на столах лежат листочки. Просмотрите текст глазами (15 секунд). Сейчас я показываю вам картинку, а вы, пользуясь текстом, который лежит у вас на столах, будете рассказывать, где встречается и используется данный металл. Отвечают, используя текст на столах (Слайды 8-9) .
III Закрепление
Сегодня мы с вами изучили щелочноземельные металлы. Что вы узнали о них? Достигли ли вы цели, поставленной вами в начале урока? Да, достигли, мы узнали их физические и химические свойства, нахождение их в природе и применение (Слайд 10). А теперь «Заполним пропуски!» (Слайд 11) . Домашнее задание. §51; подготовить об истории открытии ЩЗ металлов по вариантам: I вариант – Be , II вариант – Mg , III вариант – Ca , IV вариант – Sr , V вариант – Ba , VI вариант – Ra (Слайд 12).
Инструктивная карточка «Физические свойства, применение и нахождение ЩЗ металлов и их соединений»
Бериллий - твердый металл светло-серого цвета. Встречается в природе в виде минералов: берилла, хризоберилла и их разновидностей: изумруда, аквамарина, александрита – известных как драгоценные камни. Бериллий и его растворимые в воде соединения высокотоксичные (ядовиты). Даже ничтожно малая примесь его в воздухе приводит к тяжёлым заболеваниям. Он находит широкое применение в технике. Добавленный к меди он сильно повышает её твёрдость, прочность, химическую стойкость, делает похожей на сталь. Основной потребитель бериллия – атомная энергетика. Потребность в нём с каждым годом растёт.
Магний - мягкий, серебристо-белый металл. Б ыл впервые получен Деви в 1808 году из белой магнезии (магнезит Mg CO 3) – минерала, найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу. Сульфат магния (одна из распространённых солей магния) называют ещё горькой солью – она придаёт морской воде горьковатый вкус. Данная соль магния используется в качестве слабительного средства. Сплавы с магнием прочнее, твёрже, легко полируются, обрабатываются и их используют в автомобильной промышленности, авиационной, ракетной технике.
Кальций - мягкий серебристо-белого цвета . Занимает пятое место по распространённости. Так же впервые получен Деви в 1808 году. Название элемента происходит от латинского слова «кальс», что значит, «известь, мягкий камень». Встречается в виде кальцита (кальцит образует залежи мела, мрамора, известняка), а также в виде минерала гипса, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения гипсовых повязок, для получения слепков. Также кальций содержится в костях и зубах человека.
Стронций - мягкий, ковкий и пластичный серебристо-золотого цвета. Встречается реже в виде минерала целестина, что с латинского означает «небесный» - сульфат стронция, образован розово-красными, бледно-голубыми кристаллами. Своё название он (стронций) получил от названия шотландской деревни Стронциан, близ которой в конце XVIII века найден редкий минерал стронцианит SrCO 3 . Основные области применения стронция и его химических соединений - это радиоэлектронная промышленность, пиротехника, металлургия
Барий - мягкий металл серебристо-белого цвета. Встречается в виде барита BaSO 4 («барис»- тяжёлый с латинского). Применяется для изготовления радиоламп, в кожевенном деле (для удаления шерсти), в сахарном производстве, для приготовления фотобумаги, выплавке специальных окон. BaSO 4 благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике – баритовая каша.
Радий - блестящий металл серебристо-золотого цвета.
Используют для изготовления светящихся красок постоянного свечения (для разметки циферблатов авиационных и морских приборов, специальных часов и других приборов).
Заполни пропуски!
Ca + … = 2CaO
… + … = Be 3 N 2
Mg + … = MgSO 4 + …
Тип урока: изучение нового материала.
Вид урока: комбинированный урок
Задачи урока:
Обучающие: формирование знаний учащихся о щелочноземельных элементах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
Методы: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
Оснащение: компьютер, таблица по технике безопасности, диск “Виртуальная лаборатория по химии”, презентация .
Ход урока
1. Организационный момент.
2. Вводное слово учителя.
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы познакомились с элементами I группы главной подгруппы – щелочными металлами. Сегодня приступаем к изучению металлов II группы главной подгруппы - щелочноземельных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
3. Актуализация знаний.
Беседа.
Где находятся щелочные металлы в периодической системе Д.И. Менделеева?
Ученик:
В периодической системе щелочные металлы расположены в I группе главной подгруппе, на внешнем уровне 1 электрон, который щелочные металлы легко отдают, поэтому во всех соединениях они проявляют степень окисления +1. С увеличением размеров атомов от лития к францию энергия ионизации атомов уменьшается и, как правило, возрастает их химическая активность.
Учитель:
Физические свойства щелочных металлов?
Ученик:
Все щелочные металлы серебристо-белого цвета с незначительными оттенками, лёгкие, мягкие и легкоплавкие. Их твёрдость и температура плавления закономерно снижаются от лития к цезию.
Учитель:
Знания Химических свойств щелочных металлов проверим в виде небольшой проверочной работы по вариантам:
- I вариант: Напишите уравнения реакции взаимодействия натрия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I вариант: Напишите уравнения реакции взаимодействия лития с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I I вариант: Напишите уравнения реакции взаимодействия калия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
Учитель: Тема нашего урока “Щелочноземельные металлы”
Задачи урока: Дать общую характеристику щелочноземельным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях этих металлов.
Определить области применения этих соединений.
Наш план урока написан на доске, будем работать соответственно плана, просмотрим презентацию .
- Положение металлов в периодической системе Д.И. Менделеева.
- Строение атома щелочных металлов.
- Физические свойства.
- Химические свойства.
- Применение щелочноземельных металлов.
Беседа.
Учитель:
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева.
1. Перечислите щелочноземельные металлы
Ученик:
Это магний, кальций, стронций, барий, радий.
Учитель:
2. Почему данные металлы назвали щелочноземельными?
Ученик:
Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название "земли"
Учитель:
3. Расположение щелочноземельные металлы в ПСХЭ Д.И. Менделеева.
Ученик:
II группа главная подгруппа. У металлов II группы главной подгруппы на внешнем энергетическом уровне содержится по 2 электрона, находящихся на меньшем удалении от ядра, чем у щелочных металлов. Поэтому их восстановительные свойства хотя и велики, но все же менее, чем у элементов I группы. Усиление восстановительных свойств также наблюдается при переходе от Mg к Ba, что связано с увеличением радиусов их атомов, во всех соединениях проявляют степень окисления +2.
Учитель: Физические свойства щелочноземельных металлов?
Ученик:
Металлы II группы главной подгруппы - это серебристо-белые вещества, хорошо проводящие тепло и электрический ток. Плотность их возрастает от Be к Ba, а температура плавления, наоборот, уменьшается. Они значительно тверже щелочных металлов. Все, кроме бериллия, обладают способностью окрашивать пламя в разные цвета.
Проблема: В каком виде щелочноземельные металлы встречаются в природе?
Почему в природе щелочноземельные металлы в основном существуют в виде соединений?
Ответ: В природе щелочноземельные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие двух неспаренных электронов на внешнем энергетическом уровне)
Физкультминутка – отдых глазам.
Учитель:
Зная общие физические свойства, активность металлов, предположите химические свойства щелочноземельных металлов. С какими веществами взаимодействуют щелочные металлы?
Ученик:
Щелочноземельные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами (с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
Учитель:
А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочноземельных металлов.
4. Лабораторная работа по виртуальной лаборатории.
Цель: провести реакции, подтверждающие химические свойства щелочноземельных металлов.
Повторяем правила техники безопасности для работы со щелочноземельными металлами.
- работать в вытяжном шкафу
- на подносе
- сухими руками
- брать в малых количествах
Работаем с текстом, который читаем по виртуальной лаборатории.
Опыт № 1.Взаимодействие кальция с водой.
Опыт № 2. Горение магния, кальция, стронция, бария
Записать уравнения реакции и наблюдения в тетрадь.
5. Подведение итогов урока, выставление оценок.
5. Рефлексия.
Что запомнилось на уроке, что понравилось.
6. Домашнее задание.
§ 12 упр.1(б) упр.4
Литература.
- Рудзитис Г.Е., Фельдман Ф.Г. Химия 9.- Москва.: Просвещение, 2001
- Габриелян О.С. Химия 9.-Москва.:Дрофа, 2008
- Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия 9.-Москва.:Дрофа 2002
- Габриелян О.С. Контрольные и проверочные работы. Химия 9.-Москва.:Дрофа, 2005.
- Коллекция Виртуальной лаборатории. Учебное электронное издание

Положение в периодической системе химических элементов Д.И.Менделеева
- I группа главная подгруппа.
Увеличивается радиус атомов,
растет восстановительная способность

Общая характеристика
элементов I группы главной подгруппы
Восстано-вительные свойства
соединения
Метал-лические свойства
Атомный радиус
Валентные
элемент
электроны
увеличиваются
увеличиваются
Li 2 O, LiOH
основные свойства
2s 1
Na 2 O, NaOH
основные свойства
3s 1
K 2 O, KOH
основные свойства
4s 1
Rb 2 O, RbOH
основные свойства
Изучение нового материала. Все сведения не появляются сразу, а имеется возможность входе беседы с учащимися проверить их мнение и вместе дать общую характеристику щелочных металлов по их положению в таблице.
5s 1
Cs 2 O, CsOH
основные свойства
6s 1
Радиоактивный
элемент
7s 1

Физические свойства щелочных металлов
Металлическая кристаллическая решетка
Твердые вещества серебристо-белого цвета
Электропроводны и теплопроводны
Легкоплавкие. пластичные

Щелочные металлы – простые вещества
Литий и натрий - мягкие щелочные металлы серебристо-белого цвета
Натрий – мягкий металл, его можно резать ножом .
Натрий
Литий

Калий и рубидий
мягкие щелочные металлы серебристо-белого цвета
Рубидий
Калий

цезий
Цезий 99,99999% в ампуле
Мягкий щелочной металл золотисто-белого цвета

Франций
из которого получают франций
- Франций - щелочной металл, обладающий как радиоактивностью, так и высокой химической активностью. Не имеет стабильных изотопов
Франций-223 (самый долгоживущий из изотопов франция, период полураспада 22,3 минуты) содержится в одной из побочных ветвей радиоактивного ряда урана-235 и может быть выделен из природных урановых минералов

Химические свойства щелочных металлов
- Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Взаимодействуют с водой с образованием гидроксидов (R–OH) щёлочей.
- Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды (кроме лития).
- Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs

Химические свойства
- 2Na + Cl 2 = 2NaCl (в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются)
- 4Li + O 2 = 2Li 2 O 2Na + O 2 = Na 2 O 2 K + O 2 = KO 2
оксид Li пероксид Na надпероксид K
3) 2Na + Н 2 = 2NaН (при нагревании 200-400 o C)
4) 6Li + N 2 = 2Li 3 N (Li - при комнатной T, остальные щелочные Me -при нагревании)
5) 2Na + 2Н 2 О = 2NaОН + Н 2
( Li - спокойно, Na - энергично,
остальные – со взрывом –
воспламеняется выделяющийся Н 2
Rb и Cs реагируют не только
с жидкой Н 2 О , но и со льдом. .
6) 2Na+ Н 2 SО 4 = Na 2 SО 4 + Н 2
(протекают очень бурно)

Гидроксиды
- KOH – едкое кали
- NaOH – едкий натр, каустическая сода, каустик
Образование гидроксидов
K 2 O + H 2 O= 2KOH
- Гидроксиды щелочных металлов, кроме Li, термостойки и не разрушаются от температуры.
- Гидроксиды реагируют с
Кислотами
2KOH + H 2 SO 4 = K 2 SO 4 + 2H 2 O
Кислотными оксидами
2KOH + SO 3 = K 2 SO 4 + 2H 2 O
Солями (если образуется нерастворимое основание).
2NaOH + CuSO 4 = Cu(OH) 2 + Na 2 SO 4

Качественное определение щелочных металлов
Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки.
Li+ - карминово-красный K+ - фиолетовый Cs+ фиолетово-синий
Na+ - желтый Rb + - красный
Li+ Na+ K+

Получение щелочных металлов
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме + Cl 2
4МеOH = 4Ме + 2Н 2 О + О 2
2) Восстановление оксидов и гидроксидов щелочных металлов:
2Li 2 O + Si = 4Li + SiO 2
KOH + Na = NаOH + K
Схема электролизера для получения натрия
Ванна состоит из стального кожуха с шамотной футеровкой, графитовым анодом А и кольцевым железный катодом К, между которыми расположена сетчатая диафрагма. Электролитом служит более легкоплавкая смесь его с 25% NaF и 12% КСl (что позволяет проводить процесс при 610–650°С). Металлический натрий собирается в верхней части кольцевого катодного пространства, откуда и переходит в сборник. По мере хода электролиза в ванну добавляют NaCl.

Применение щелочных металлов

Биологическая роль и применение
Соединений калия и натрия
Раствор хлорида натрия (0,9%) применяется в медицине. Такой раствор называется физиологическим
Питьевая сода применяется в кулинарии, для выпечки кондитерских изделий.
Хлорид натрия - как добавка к пище
Сколько воды и хлорида натрия нужно взять для приготовления физиологического раствора
массой 0,5 кг?
Хлорид калия - очень ценное минеральное удобрение. Рассчитайте массовую долю калия (%) в этом веществе.
Смесь хлорида и гидрокарбоната натрия массой 15 г обработали уксусной кислотой, при этом выделилось 2,8 л (н.у.) газа. Определите массовые доли в процентах компонентов смеси.
Тривиальные названия солей:
70% NaHCO 3
4,5г соли
495,5 г воды
Поваренная соль
30% NaCl
Калийные удобрения играю важную роль в жизни растений.
Для работы слайда необходимо кликнуть мышью на любой синий прямоугольник. Для 1-3 ячейки таблицы это задача. Для 4 ячейки - проверка знаний тривиальных названий веществ.
Калийная селитра
Na 2 CO 3 *10H 2 O
Кристалли-ческая сода
Na 2 SO 4 *10H 2 O
Глауберова соль
Питьевая сода

Охладитель в ядерных реакторах
В медицине
При изготовлении фарфора
В металлургии для удаления примесей

Калийные удобрения. Влияет на интенсивность фотосинтеза у растений
Внутриклеточный ион. Поддерживает работу сердечной мышцы (курага, бобовые, чернослив, изюм)
Бертолетова соль – обязательная часть праздничного фейерверка

Na+ внеклеточный ион (содержится в крови и лимфе)

Изготовление фотоэлементов
В медицине как болеутоляющие и успокоительные средства
В научных исследованиях

Промотор в каталитических процессах
Производство специальных стекол
Производство приборов радиационного контроля

Фотография
Описание минерала
Химический состав
Бесцветный, красный, желтый, зеленый
Плотность
3,1-3,2 г/см 3
Твердость
Сподуменн

Фотография
Описание минерала
Химический состав
Бесцветный, красный, желтый, синий
Плотность
2,2-2,3г/см 3
Твердость
Галит

Природные соединения калия
Фотография
Описание минерала
Химический состав
Бесцветный, молочно-белый, темно-красный, розовый
Плотность
Твердость
1,97-1,99 г/см 3
Сильвин

Природные соединения калия
Фотография
Описание минерала
Химический состав
MgCl 2 ·KCl·6H 2 O
Красный, желтый, белый, бесцветный
Плотность
Твердость
Жгучий соленый
Карналит

Спасибо за урок!
Элемен т Ar Количе ство электронов на послед нем уровне СО Атомн ый радиус Металл ически е свойства Восста новите льные свойства Be9 2s2 +2)) Mg243s2+2))) Ca404s2+2)))) Sr885s2+2))))) Ba1376s2+2)))))) Ra7s2+2))))))) Общая характеристика элементов главной подгруппы II группы

Краткая электронная запись - 2s22s2 2s22s2 2p62p6 2p62p6 3s23s2 3s23s2 3p63p6 3p63p6 4s24s2 3d03d0


Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют СО +2 Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами. Атомы элементов являются сильными восстановителями, т.к содержат 2 электрона на внешнем энергетическом уровне, которые отдают при взаимодействиями с другими элементами. С увеличением элементов увеличивается атомный радиус, увеличивается число электронных слоев, следовательно возрастает легкость отдачи электронов. Восстановительные свойства увеличиваются в группе сверху вниз.



2Me 0 +O 2 2Me +2 O -2 Me 0 +H 2 Me +2 H 2 Me 0 +Cl 0 2 Me +2 Cl 2 Me 0 +S 0 Me +2 S -2 Me 0 +2HCl Me +2 Cl 2 + H 2 Me 0 +2HOH Me +2 (OH) 2 +Н 2 Химические свойства элементов II группы главной подгруппы Химические свойства элементов II группы главной подгруппы

Соединения щелочноземельных металлов Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей. Оксиды щелочноземельных металлов легко реагируют с оксидами неметаллов с образованием соответствующих солей.




 15
15

Сравните атомы элементов, поставив знаки или = вместо *: Сравните атомы элементов, поставив знаки или = вместо *: а) заряд ядра: Mg * Ca, Na *Mg, Ca * К; б) число электронных слоев: Mg * Ca, Na * Mg, Ca * К; Ca * К; в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К; г) радиус атома: Mg * Ca, Na * Mg, Ca * K; д) восстановительные свойства: Mg * Ca, Na * Mg, Ca * K. Ca * K. Проверка знаний

Открытие бизнеса

Где можно и где нельзя работать после туберкулеза Где можно работать после
Форекс
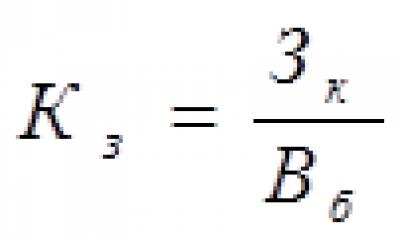
Направления повышения эффективности использования собственного капитала На базе двигателя с плоским печатным якорем разработаны изделия для автомобильной промышленности
Банки