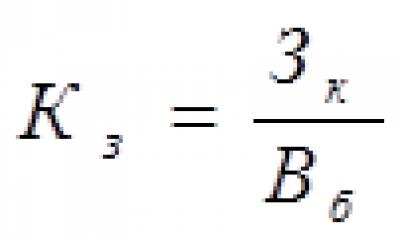Среди всех существующих видов разрушения металлов наиболее часто встречается электрохимическая коррозия, которая возникает в результате его взаимодействия с электролитически проводящей средой. Основная причина данного явления – это термодинамическая неустойчивость металлов в средах, которые их окружают.

Этому виду коррозии подвержены многие объекты и конструкции:
- газовые и водные трубопроводы;
- элементы транспортных средств;
- другие конструкции, изготовленные из металла.
Коррозийные процессы, то есть, ржавчина, могут возникать в атмосфере, в грунте, и даже в соленой воде. Очистка металлоконструкций от проявлений электрохимической коррозии является сложным и длительным процессом, поэтому проще предотвратить ее возникновение.
Основные разновидности
При коррозии в электролитах происходит преобразование химической энергии в электрическую. В связи с этим ее называют электрохимической. Принято различать следующие виды электрохимической коррозии.
Межкристаллитная
Под межкристаллитной коррозией подразумевается такое опасное явление, при котором происходит разрушение границ зерна никеля, алюминия и других металлов избирательным образом. Как следствие, прочностные и пластичные свойства материала утрачиваются. Главная опасность этой разновидности коррозии в том, что далеко не всегда она заметна визуально.

Питтинговая
Питтинговая электрохимическая коррозия представляет собой точечное поражение отдельных участков поверхности меди и других металлов. В зависимости от характера поражения, различают закрытый, открытый, а также поверхностный питтинг. Размеры пораженных участков могут варьироваться от 0,1 мм до 1,5 мм.

Щелевая
Щелевой электрохимической коррозией принято называть усиленный процесс разрушения металлических конструкций в местах расположения щелей, зазоров и трещин. Протекание щелевой коррозии может происходить в воздушной атмосфере, газовых смесях, а также морской воде. Данный вид разрушения характерен для газопроводов, днищ морских судов и многих других объектов.
Распространено протекание коррозии в условиях небольшого количества окислителя из-за затрудненного подхода к стенкам щели. Это приводит к накоплению коррозийных продуктов внутри зазоров. Электролит, содержащийся во внутреннем пространстве зазора, может изменяться под воздействием гидролиза продуктов коррозии.

С целью защиты металлов от щелевой коррозии принято применять несколько методов:
- уплотнение зазоров и щелей;
- электрохимическая защита;
- процесс ингибирования.
В качестве профилактических методов следует использовать только те материалы, которые в наименьшей степени подвержены возникновению ржавчины, а также изначально грамотно и рационально конструировать газопроводы и другие важные объекты.
Грамотная профилактика во многих случаях представляет собой более простой процесс, чем последующая очистка металлоконструкций от въевшейся ржавчины.
Как проявляется коррозия разных видов
В качестве примера протекания коррозийного процесса можно привести разрушение различных приборов, компонентов автомобилей, а также любых конструкций, произведенных из металла и расположенных:
- в атмосферном воздухе;
- в водах – моря, реки, содержащиеся в почве и под слоями грунта;
- в технических средах и т.д.

В процессе ржавления металл становится многоэлектронным гальваническим элементом. Так, например, если в электролитической среде происходит контакт меди и железа, медь является катодом, а железо – анодом. Отдавая электроны меди, железо в виде ионов попадает в раствор. Ионы водорода начинают двигаться по направлению к меди и там разряжаются. Становясь все более и более отрицательным, катод вскоре приравнивается к потенциалу анода, в результате чего коррозийный процесс начинает замедляться.
Разные виды коррозии проявляются по-разному. Более интенсивно электрохимическая коррозия проявляется в тех случаях, когда в катоде присутствуют вкрапления металла с меньшей активностью по сравнению с корродирующим – на них ржавчина появляется быстрее и является довольно выразительной.
Протекание атмосферной коррозии происходит в условиях влажного воздуха и обычной температуры. В данном случае на поверхности металла образуется пленочка из влаги с растворенным кислородом. Процесс разрушения металла становится интенсивнее по мере увеличения влажности воздуха и содержания газообразных оксидов углерода и серы при условии наличия:
- трещин;
- шероховатостей;
- других факторов, провоцирующих облегчения процесса конденсации.

Почвенная коррозия в наибольшей степени поражает разнообразные подземные сооружения, газопроводы, кабели и другие конструкции. Разрушение меди и других металлов происходит по причине их тесного соприкосновения с почвенной влагой, в составе которой также присутствует растворенный кислород. Разрушение трубопроводов может произойти уже спустя полгода с момента их строительства в том случае, если для почвы, в которой они установлены, характерна повышенная кислотность.
Под воздействием блуждающих токов, исходящих от посторонних объектов, возникает электрическая коррозия. Ее главными источниками являются электрические железные дороги, линии электропередач, а также специальные установки, функционирующие на постоянном электротоке. В большей степени данный вид коррозии провоцирует разрушение:
- газопроводов;
- всевозможных сооружений (мосты, ангары);
- электрокабелей;
- нефтепроводов.
Действие тока провоцирует возникновение участков входа и выхода электронов – то есть, катодов и анодов. Наиболее интенсивным разрушительный процесс является именно на участках с анодами, поэтому на них ржавчина более заметна.
Коррозия отдельных компонентов газопроводов и водяных трубопроводов может быть вызвана тем, что процесс их инсталляции является смешанным, то есть, происходит с использованием различных материалов. Наиболее частыми примерами является точечная коррозия, возникающая в элементах из меди, а также коррозия биметаллов.
При смешанной установке железных элементов со сплавами меди и цинка, процесс коррозии отличается меньшей степенью критичности, чем при медном литье, то есть со сплавами меди, цинка и олова. Предотвратить коррозию трубопроводов можно, используя специальные методы.

Способы защиты от ржавления
Для борьбы с коварной ржавчиной применяются различные методы. Рассмотрим те из них, который являются наиболее эффективными.
Способ №1
Один из самых популярных методов – это электрохимическая защита чугуна, стали, титана, меди и других металлов. На чем же она основывается?
Электрохимическая обработка металлов представляет собой особый способ, направленный на изменение формы, размеров и шероховатости поверхности путем анодного растворения в электролите под воздействием электротока.
Чтобы обеспечить надежную защиту от ржавчины, необходимо еще перед началом эксплуатации металлических изделий обрабатывать их особым средствами, которые в своем составе содержат различные компоненты органического и неорганического происхождения. Данный метод позволяет предотвратить появление ржавчины на определенное время, однако позже придется обновлять покрытие.

Электрозащита представляет собой процесс, при котором металлическая конструкция подключается к внешнему источнику постоянного электрического тока. В результате этого на ее поверхности формируется поляризация электродов катодного типа, и все анодные области начинают преобразовываться в катодные.
Электрохимическая обработка металлов может происходить с участием анода или катода. В некоторых случаях происходит попеременная обработка металлического изделия обоими электродами.
Катодная защита от коррозии необходима в тех ситуациях, когда у металла, подлежащего защите, не наблюдается предрасположенность к пассивации. К металлическому изделию подключается источник внешнего тока – специальная станция катодной защиты. Данный метод подходит для защиты газопроводов, а также трубопроводов водоснабжения и отопления. Однако есть у этого метода определенные недостатки в виде растрескивания и разрушения защитных покрытий – это происходит в случаях значительного смещения потенциала объекта в отрицательную сторону.
Способ №2
Электроискровая обработка металлов может осуществляться при помощи установок различных типов – бесконтактной, контактной, а также анодно-механической.
Способ №3
Для надежной защиты газопроводов и других трубопроводов от ржавчины часто применяется такой метод, как электродуговое напыление. Преимущества данного способа очевидны:

- значительная толщина защитного слоя;
- высокий уровень производительности и надежности;
- применение относительно недорогого оборудования;
- несложный технологический процесс;
- возможность применения автоматизированных линий;
- невысокие энергетические затраты.
Среди недостатков данного метода – невысокая эффективность при обработке конструкций в коррозийных средах, а также недостаточная прочность сцепления со стальной основой в некоторых случаях. В любых других ситуациях такая электрозащита очень эффективна.
Способ №4
Для защиты разнообразных металлических конструкций – газопроводов, мостовых сооружений, всевозможных трубопроводов – требуется эффективная антикоррозийная обработка.

Данная процедура осуществляется в несколько этапов:
- тщательное удаление жировых отложений и масел с применением эффективных растворителей;
- очистка обрабатываемой поверхности от солей, растворимых в воде, – выполняется при помощи профессиональных аппаратов высокого давления;
- удаление имеющихся конструкционных погрешностей, выравнивание кромок – это необходимо для предотвращения сколов наносимого лакокрасочного покрытия;
- тщательная очистка поверхности при помощи пескоструйного аппарата – это делается не только для удаления ржавчины, но и для придания нужной степени шероховатости;
- нанесение противокоррозийного материала и дополнительного защитного слоя.
Правильная предварительная обработка газопроводов и всевозможных металлоконструкций обеспечит им надежную защиту от электрохимической коррозии в процессе эксплуатации.
На скорость химической (газовой) коррозии металлов и сплавов влияют внешние и внутренние факторы.
К внешним факторам относятся состав и давление газовой среды, скорость её движения, температура, режим нагрева.
Состав газовой среды . При высоких температурах металлы взаимодействуют с кислородом, парами воды, оксидом углерода (lV), оксидом серы (lV) по схеме
2М + О 2 = 2МО,
М + СО 2 = МО + СО,
М + Н 2 О = МО + Н 2 ,
3М + SО 2 = 2МО + МS.
Скорости этих химических реакций и защитные свойства образующихся плёнок различны, следовательно, скорости коррозии металлов в указанных средах также различны.
Из экспериментальных данных известно, что при 900 0 С ско-рость окисления Fe, Co, Ni возрастает в ряду
Н 2 О (П) ® СО 2 ® О 2 ® SО 2
В отличие от этих металлов Cu практически не корродирует в атмосфере SO 2 .
В приведенных выше газах скорость газовой коррозии металлов увеличивается в ряду
Cr ® Ni ® Co ® Fe
Вольфрам при 900 0 С наибольшую скорость коррозии имеет в атмосфере О 2 , а наименьшую ─ в СО 2 .
Загрязнение воздуха СО 2 , SО 2 , парами Н 2 О вызывает повышение скорости коррозии малоуглеродистой стали. Это связывают с увеличением несовершенств в оксидной плёнке.
При нагревании стали в атмосфере, содержащей О 2 , СО 2 , Н 2 О, помимо окисления, может происходить обезуглероживание (декарбонизация)
Fe 3 C + 1/2O 2 = 3Fe + CO,
Fe 3 C + CO 2 = 3Fe + 2CO,
Fe 3 C + H 2 O = 3Fe + CO + H 2 .
Наводороживание стали происходит при высоких температурах адсорбированными на её поверхности атомами водорода. При комнатной температуре молекулы Н 2 не диссоциируют, поэтому наводороживания стали не происходит. Наводороживание вызывает резкое уменьшение пластичности, понижает длительную прочность металлов. Склонен к наводороживанию титан.
Температура . Повышение температуры вызывает увеличение константы скорости химической реакции, а также рост скорости диффузии реагентов в плёнке продуктов коррозии. Это приводит к увеличению скорости газовой коррозии металлов и сплавов ─ Fe, Cu, и др.
Температура может оказывать влияние на состав образующихся плёнок и закон их роста (таблица 1).
Большое влияние на скорость окисления оказывает режим нагрева. Колебания температуры при нагреве и особенно попеременный нагрев и охлаждение вызывают разрушение плёнки вследствие возникновения больших внутренних напряжений, в результате чего скорость окисления металлов увеличивается.
Таблица 1 ─ Влияние температуры на состав и закон роста оксид-
ных плёнок
Давление газа . С повышением парциального давления кислорода скорость коррозии металлов возрастает.
Для некоторых металлов и сплавов при постоянной достаточно высокой температуре с увеличением парциального давления кислорода скорость окисления сначала растёт, а затем при достижении некоторого критического значения Ро 2 ─ резко уменьшается (рисунок 7) и в широком диапазоне давлений остаётся достаточно низкой.

Р О 2 КР Р О 2
Рисунок 7 - Влияние парциального давления кислорода на
скорость газовой коррозии
Явление уменьшения скорости газовой коррозии при повышении парциального давления кислорода называют высокотемпературной пассивацией. Пассивное состояние металла связывают с образованием на его поверхности совершенной плёнки.
Высокотемпературную пассивацию имеют хромистые стали, медь, титан, цинк и другие металлы и сплавы.
При значительном увеличении парциального давления кислорода выше критического, у целого ряда нержавеющих сталей, например, 08Х13 (Х13), 30Х13 (Х13), 12Х17 (Х17), 08Х18Н10Т (Х18Н10Т) происходит нарушение пассивного состояния («перепассивация»), что приводит к увеличению скорости окисления.
Увеличение скорости коррозии при высоких температурах может вызвать повышение скорости движения газовой среды.
К внутренним факторам, влияющим на скорость химической коррозии металлов относятся: природа, химический и фазовый состав сплава, механические напряжения и деформация, характер обработки поверхности.
Состав и структура сплава . Скорость окисления сталей при высоких температурах с повышением содержания углерода понижается. Уменьшается обезуглероживание сталей. Это связано с интенсификацией процесса образования оксида углерода (II). Сера и фосфор практически не влияют на скорость окисления стали.
На скорость коррозии стали, в кислородсодержащей среде влияют легирующие элементы. Хром (Cr), алюминий (Al) и кремний (Si) сильно замедляют процесс окисления стали. Это связано с обра-зованием плёнок с высокими защитными свойствами. При содержании приблизительно 30 % Cr, до 10 % Al, до 5 % Si, стали имеют высокую жаростойкость. Меньшее повышение жаростойкости дает легирование стали титаном (Ti), медью (Cu), кобальтом (Со) и бериллием (Be).
Элементы, образующие легкоплавкие или летучие оксиды, например, ванадий (V), молибден (Мо), вольфрам (W) ускоряют оки-сление стали.
Высокой жаростойкостью обладают сплавы никеля (Ni) c хромом (Сr) - нихромы. Типичные нихромы содержат 80 % Ni и 20 % Cr или 65 % Ni, 20 % Cr и 15 % Fe.
Скорость окисления меди (Cu) понижается при её легировании Al, Be, оловом (Sn) и цинком (Zn).
На скорость коррозии влияет также структура сплава . Установлено, что наиболее жаростойкой является сталь с аустенитной (однофазной) структурой. Хромоникелевые стали с двухфазной аустенитно-ферритной структурой менее устойчивы к окислению. С увеличением содержания ферритной составляющей скорость окисления стали повышается. Например, хромоникелевая аустенитная сталь 12Х18Н9Т (Х18Н9Т) имеет более высокую жаростойкость, чем двухфазная сталь Х12Н5Т с более высоким содержанием хрома. Это связывают с тем, что на двухфазных сталях образуются менее совершенные плёнки, чем на однофазных.
Жаростойкость чугуна зависит от формы графитовых выделений. При шаровидной форме графита жаростойкость чугуна выше.
Деформация металлов в процессе нагрева может вызвать нарушение сплошности плёнок и связанное с этим увеличение скорости окисления. Повышенная шероховатость поверхности металла способствует образованию защитных плёнок с дефектами, что ведет к увеличению скорости коррозии.
Коррозия металлов (от позднелат. corrosio — разъедание) — физико-химическое взаимодействие металлического материала и среды, приводящее к ухудшению эксплуатационных свойств материала, среды или технической системы, частями которой они являются.
В основе коррозии металлов лежит химическая реакция между материалом и средой или между их компонентами, протекающая на границе раздела фаз. Это процесс является самопроизвольным, а также является следствием
окислительно-восстановительных реакций
с компонентами окружающей среды. Химические вещества, разрушающие строительные материалы, называются агрессивными. Агрессивной средой может служить атмосферный воздух, вода, различные растворы химических веществ, газы. Процесс разрушения материала усиливается при наличии в воде даже незначительного количества кислот или солей, в почвах при наличии в почвенной воде солей и колебаниях уровня грунтовых вод.
Коррозионные процессы классифицируют:
1) по условиям протекания коррозии,
2) по механизму процесса,
3) по характеру коррозионного разрушения.
|
|
|
По условиям протекания коррозии , которые весьма разнообразны, различают несколько видов коррозии.
Коррозионные среды и вызываемые ими разрушения столь характерны, что по названию этих сред классифицируются и протекающие в них коррозионные процессы. Так, выделяют газовую коррозию , т. е. химическую коррозию под действием горячих газов (при температуре много выше точки росы).
Характерны некоторые случаи электрохимической коррозии (преимущественно с катодным восстановлением кислорода) в природных средах: атмосферная - в чистом или загрязнённом воздухе при влажности, достаточной для образования на поверхности металла плёнки электролита (особенно в присутствии агрессивных газов, например СО 2 , Cl 2 , или аэрозолей кислот, солей и т. п.); морская - под действием морской воды и подземная - в грунтах и почвах.
Коррозия под напряжением развивается в зоне действия растягивающих или изгибающих механических нагрузок, а также остаточных деформаций или термических напряжений и, как правило, ведёт к транскристаллитному коррозионному растрескиванию, которому подвержены, например, стальные тросы и пружины в атмосферных условиях, углеродистые и нержавеющие стали в паросиловых установках, высокопрочные титановые сплавы в морской воде и т. д.
При знакопеременных нагрузках может проявляться коррозионная усталость , выражающаяся в более или менее резком понижении предела усталости металла в присутствии коррозионной среды. Коррозионная эрозия (или коррозия при трении ) представляет собой ускоренный износ металла при одновременном воздействии взаимно усиливающих друг друга коррозионных и абразивных факторов (трение скольжения, поток абразивных частиц и т. п.).
Родственная ей кавитационная коррозия возникает при кавитационных режимах обтекания металла агрессивной средой, когда непрерывное возникновение и «захлопывание» мелких вакуумных пузырьков создаёт поток разрушающих микрогидравлических ударов, воздействующих на поверхность металла. Близкой разновидностью можно считать и фреттинг- коррозию , наблюдаемую в местах контакта плотно сжатых или катящихся одна по другой деталей, если в результате вибраций между их поверхностями возникают микроскопические смещения сдвига.
Утечка электрического тока через границу металла с агрессивной средой вызывает в зависимости от характера и направления утечки дополнительные анодные и катодные реакции, могущие прямо или косвенно вести к ускоренному местному или общему разрушению металла (коррозию блуждающим током ). Сходные разрушения, локализуемые вблизи контакта, может вызвать соприкосновение в электролите двух разнородных металлов, образующих замкнутый гальванический элемент, - контактная коррозия .
В узких зазорах между деталями, а также под отставшим покрытием или наростом, куда проникает электролит, но затруднён доступ кислорода, необходимого для пассивации металла, может развиваться щелевая коррозия , при которой растворение металла в основном происходит в щели, а катодные реакции частично или полностью протекают рядом с ней на открытой поверхности.
Принято выделять также биологическую коррозию , идущую под влиянием продуктов жизнедеятельности бактерий и др. организмов, и радиационную коррозию - при воздействии радиоактивного излучения.
1 . Газовая коррозия - коррозия металлов в газах при высоких температурах (например, окисление и обезуглероживание стали при нагревании);
2. Атмосферная коррозия - коррозия металлов в атмосфере воздуха, а также любого влажного газа (например, ржавление стальных конструкций в цехе или на открытом воздухе);
Атмосферная коррозия является самым распространенным видом коррозии; около 80% металлоконструкций эксплуатируется в атмосферных условиях.
Основным фактором, определяющим механизм и скорость атмосферной коррозии, является степень увлажнения поверхности металла. По степени увлажнения различают три основных типа атмосферной коррозии:
- Мокрая атмосферная коррозия
– коррозия при наличии на поверхности металла видимой пленки воды (толщина пленки от 1мкм до 1 мм). Коррозия этого типа наблюдается при относительной влажности воздуха около 100%, когда имеет место капельная конденсация воды на поверхности металла, а также при непосредственном попадании воды на поверхность (дождь, гидроочистка поверхности и т. п.);
- Влажная атмосферная коррозия
– коррозия при наличии на поверхности металла тонкой невидимой пленки воды, которая образуется в результате каппилярной, адсорбционной или химической конденсации при относительной влажности воздуха ниже 100% (толщина пленки от 10 до 1000 нм);
- Сухая атмосферная коррозия
– коррозия при наличии на поверхности металла очень тонкой адсорбционной пленки воды (порядка нескольких молекулярных слоев общей толщиной от 1 до 10 нм), которую еще нельзя рассматривать, как сплошную и обладающую свойствами электролита.
Очевидно, что минимальные сроки коррозии имеют место при сухой атмосферной коррозии, которая протекает по механизму химической коррозии.
С увеличением толщины пленки воды происходит переход механизма коррозии от химического к электрохимическому, что соответствует быстрому возрастанию скорости коррозионного процесса.
Из приведенной зависимости видно, что максимуму скорости коррозии отвечает граница областей II и III, затем наблюдается некоторое замедление коррозии вследствие затруднения диффузии кислорода через утолщенный слой воды. Еще более толстые слои воды на поверхности металла (участок IV) приводят лишь к незначительному замедлению коррозии, так как в меньшей степени будут влиять на диффузию кислорода.
На практике не всегда можно так отчетливо разграничить эти три этапа атмосферной коррозии, так как в зависимости от внешних условий возможен переход от одного типа к другому. Так, например, металлоконструкция, которая корродировала по механизму сухой коррозии, при увеличении влажности воздуха начнет коррозировать по механизму влажной коррозии, а при выпадении осадков уже будет иметь место мокрая коррозия. При высыхании влаги процесс будет изменяться в обратном направлении.
На скорость атмосферной коррозии металлов оказывает влияние ряд факторов. Основным из них следует считать длительность увлажнения поверхности, которая определяется главным образом величиной относительной влажности воздуха. При этом в большинстве практических случаев скорость коррозии металла резко увеличивается только при достижении некоторой определенной критической величины относительной влажности, при которой появляется сплошная пленка влаги на поверхности металла в результате конденсации воды из воздуха.
Влияние относительной влажности воздуха на скорость атмосферной коррозии углеродистой стали показано на рисунке Зависимость увеличения массы продуктов коррозии m от относительной влажности воздуха W получена при экспозиции стальных образцов в атмосфере, содержащей 0,01% SO 2 , в течении 55 суток.
Очень сильно влияют на скорость атмосферной коррозии содержащиеся в воздухе примеси SO 2 , H 2 S, NH 3 , HCl и др. Растворяясь в пленке воды, они увеличивают ее электропроводность и
Твердые частицы из атмосферы, попадающие на поверхность металла, могут, растворяясь, действовать как вредные примеси (NaCl, Na 2 SO 4), либо в виде твердых частиц облегчать конденсацию влаги на поверхности (частицы угля, пыль, частицы абразива и т.п.).
На практике трудно выявить влияние отдельных факторов на скорость коррозии металла в конкретных условиях эксплуатации, но можно приблизительно оценить ее, исходя из обобщенных характеристик атмосферы (оценка дается в относительных единицах):
сухая континентальная — 1-9
морская чистая — 38
морская индустриальная — 50
индустриальная — 65
индустриальная, сильно загрязненная – 100.
3 . Жидкостная коррозия - коррозия металлов в жидкой среде: в неэлектролите (бром, расплавленная сера, органический растворитель, жидкое топливо) и в электролите (кислотная, щелочная, солевая, морская, речная коррозия, коррозия в расплавленных солях и щелочах). В зависимости от условий взаимодействия среды с металлом различают жидкостную коррозию металла при полном, неполном и переменном погружении, коррозию по ватерлинии (вблизи границы между погруженной и непогруженной в коррозионную среду частью металла), коррозию в неперемешиваемой (спокойной) и перемешиваемой (движущейся) коррозионной среде;
|
|
|
|
|
Жидкостная коррозия |
||
4. Подземная коррозия - коррозию металлов в почвах и грунтах (например, ржавление подземных стальных трубопроводов);
|
|
|
|
Подземная коррозия |
|
По своему механизму является электрохим. коррозией металлов. подземная коррозия обусловлена тремя факторами: коррозионной агрессивностью почв и грунтов (почвенная коррозия), действием блуждающих токов и жизнедеятельностью микроорганизмов.
Коррозионная агрессивность почв и грунтов определяется их структурой, грану-лометрич. составом, уд. электрич. сопротивлением, влажностью, воздухопроницаемостью, рН и др. Обычно коррозионную агрессивность грунта по отношению к углеродистым сталям оценивают по уд. электрич. сопротивлению грунта, средней плотности катодного тока при смещении электродного потенциала на 100 мВ отрицательнее коррозионного потенциала стали; по отношению к алюминию коррозионная активность грунта оценивается содержанием в нем ионов хлора, железа, значением рН, по отношению к свинцу-содержанием нитрат-ионов, гумуса, значением рН.
5. Биокоррозия - коррозия металлов под влиянием жизнедеятельности микроорганизмов (например, усиление коррозии стали в грунтах сульфат-редуцирующими бактериями);
|
|
|
|
Биокоррозия |
|
Биокоррозия подземных сооружений обусловлена в осн. жизнедеятельностью сульфатвосстанавливающих, сероокис-ляющих и железоокисляющих бактерий, наличие к-рых устанавливают бактериологич. исследованиями проб грунта. Сульфатвосстанавливающие бактерии присутствуют во всех грунтах, но с заметной скоростью биокоррозия протекает только тогда, когда воды (или грунты) содержат 105-106 жизнеспособных бактерий в 1 мл (или в 1 г).
6. С труктурная коррозия - коррозия, связанную со структурной неоднородностью металла (например, ускорение коррозионного процесса в растворах H 2 S0 4 или НСl катодными включениями: карбидами в стали, графитом в чугуне, интерметаллидом СuА1 3 в дюралюминии);
|
|
|
|
Структурная коррозия |
|
7. Коррозия внешним током - электрохимическая коррозия металлов под воздействием тока от внешнего источника (например, растворение стального анодного заземления станции катодной защиты подземного трубопровода);
|
|
 |
|
Коррозия внешним током |
|
8. Коррозия блуждающим током - электрохимическая коррозия металла (например, подземного трубопровода) под воздействием блуждающего тока;
Основные источники блуждающих токов в земле -электрифи-цир. железные дороги постоянного тока, трамвай, метрополитен, шахтный электротранспорт, линии электропередач постоянного тока по системе провод — земля. Наибольшие разрушения блуждающие токи вызывают в тех местах подземного сооружения, где ток стекает с сооружения в землю (т. наз. анодные зоны).Потери железа от коррозии блуждающими токами составляют 9,1 кг/А·год.
На подземные металлич. сооружения могут натекать токи порядка сотен ампер и при наличии повреждений в защитном покрытии плотность тока, стекающего с сооружения в анодной зоне, настолько велика, что за короткий период в стенках сооружения образуются сквозные повреждения. Поэтому при наличии анодных или знакопеременных зон на подземных металлич. сооружениях коррозия блуждающими токами обычно опаснее почвенной коррозии.
9. Контактная коррозия - электрохимическая коррозия, вызванная контактом металлов, имеющих разные стационарные потенциалы в данном электролите (например, коррозия в морской воде деталей из алюминиевых сплавов, находящихся в контакте с медными деталями).
|
|
|
|
Контактная коррозия |
|
Контактная коррозия в электролитах с высокой электропроводностью может возникать в следующих частных случаях:
при контакте низколегированной стали различных марок, если одна из них легирована медью и (или) никелем;
при введении этих элементов в сварные швы в процессе сварки стали, не легированной этими элементами;
при воздействии на конструкции из стали, не легированной медью и никелем, а также из оцинкованной стали или из алюминиевых сплавов, пыли, содержащей тяжелые металлы или их оксиды, гидрооксиды, соли; перечисленные материалы являются катодами по отношению к стали, алюминию, металлическим защитным покрытиям;
при попадании на конструкции из перечисленных материалов потеков воды с корродирующих медных деталей;
при попадании на поверхность конструкций из оцинкованной стали или алюминиевых сплавов графитовой либо железорудной пыли, коксовой крошки;
при контакте алюминиевых сплавов между собой, если один сплав (катодный) легирован медью, а другой (анодный) ¾ нет;
10. щелевая коррозия - усиление коррозии в щелях и зазорах между металлами (например, в резьбовых и фланцевых соединениях стальных конструкций, находящихся в воде), а также в местах неплотного контакта металла с неметаллическим коррозионноинертным материалом. Присуща конструкциям из нержавеющей стали в агрессивных жидких средах, в которых материалы вне узких щелей и зазоров устойчивы благодаря пассивному состоянию т.е. вследствие образования на их поверхности защитной пленки;
11. Коррозия под напряжением - коррозия металлов при одновременном воздействии коррозионной среды и механических напряжений. В зависимости от характера нагрузок может быть коррозия при постоянной нагрузке (например, коррозия металла паровых котлов) и коррозия при переменной нагрузке (например, коррозия осей и штоков насосов, рессор, стальных канатов); одновременное воздействие коррозионной среды и знакопеременных или циклических растягивающих нагрузок часто вызывает коррозионную усталость - понижение предела усталости металла;
|
|
|
|
Коррозия под напряжением |
|
12. Коррозионная кавитация - разрушение металла, вызванное одновременным коррозионным и ударным воздействием внешней среды (например, разрушение лопастей гребных винтов морских судов);
|
|
|
|
Коррозионная кавитация |
|
Кавитация - (от лат. cavitas - пустота) - образование в жидкости полостей (кавитационных пузырьков, или каверн), заполненных газом, паром или их смесью. Кавитация возникает в результате местного понижения давления в жидкости, которое может происходить при увеличении её скорости (гидродинамическая кавитация). Перемещаясь с потоком в область с более высоким давлением или во время полупериода сжатия, кавитационный пузырек захлопывается, излучая при этом ударную волну.
Кавитация во многих случаях нежелательна. На устройствах, например, винтах и насосах, кавитация вызывает много шума, повреждает их составные части, вызывает вибрации и снижение эффективности.
Когда разрушаются кавитационные пузыри, энергия жидкости сосредотачивается в очень небольших объемах. Тем самым, образуются места повышенной температуры и возникают ударные волны, которые являются источниками шума. При разрушении каверн освобождается много энергии, что может вызвать основные повреждения. Кавитация может разрушить практически любое вещество. Последствия, вызванные разрушением каверн, ведут к большому износу составных частей и могут значительно сократить срок службы винта и насоса.
Для предотвращения кавитации
- подбирают устойчивый к данному виду эрозии материал (молибденовые стали);
- уменьшают шероховатость поверхности;
- снижают турбулентность потока, уменьшают количество поворотов, делают их более плавными;
- не допускают прямого удара эрозийной струи в стенку аппарата, применяя отражатели, рассекатели струй;
- очищают газы и жидкости от твердых примесей;
- не допускают работу гидравлических машин в режиме кавитации;
- ведут систематический контроль за износом материала.
13. коррозия при трении (коррозионная эрозия) - разрушение металла, вызываемое одновременным воздействием коррозионной среды и трения (например, разрушение шейки вала при трении о подшипник омываемый морской водой);
14. Фреттинг-коррозия - коррозия металлов при колебательном перемещение двух поверхностей относительно друг друга в условиях воздействия коррозионной среды (например, разрушение двух поверхностей металлических деталей машины, плотно соединенных болтами, в результате вибрации в окислительной атмосфере, содержащей кислород).
|
|
|
|
Фреттинг-коррозия |
|
По механизму процесса
различают химическую и электрохимическую коррозию металлов:
1.
химическая коррозия
- взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Примерами такого типа коррозии являются реакции, протекающие при соприкосновении металлоконструкций с кислородом или другими окисляющими газами при высокой температуре (свыше 100°С):
2 Fe + O 2 = FeO;
4FeO + 3O 2 = 2Fe 2 O 3 .
Если в результате химической коррозии образуется сплошная оксидная пленка, имеющая достаточно прочную адгезию с поверхностью металлоконструкции, то доступ кислорода к металлу затрудняется, коррозия замедляется, а затем прекращается. Пористая, плохо сцепленная с поверхностью конструкции оксидная пленка не защищает металл от коррозии. Когда объем оксида больше объема вступившего в реакцию окисления металла и оксид имеет достаточную адгезию с поверхностью металлоконструкции, такая пленка хорошо защищает металл от дальнейшего разрушения. Толщина защитной пленки оксида колеблется от нескольких молекулярных слоев (5-10)х10 –5 мм до нескольких микронов.
Окисление материала металлоконструкций, соприкасающихся с газовой средой, происходит в котлах, дымовых трубах котельных, водонагревателях, работающих на газовом топливе, теплообменниках, работающих на жидком и твердом топливе. Если бы газообразная среда не содержала диоксида серы или других агрессивных примесей, а взаимодействие металлоконструкций со средой происходило при постоянной температуре по всей плоскости конструкции, то относительно толстая оксидная пленка служила бы достаточно надежной защитой от дальнейшей коррозии. Но в связи с тем, что тепловое расширение металла и оксида различно, оксидная пленка отслаивается местами, что создает условия для дальнейшей коррозии.
 Газовая коррозия стальных конструкций может протекать вследствие не только окислительных, но и восстановительных процессов. При сильном нагреве стальных конструкций под высоким давлением в среде, содержащей водород, последний диффундирует в объем стали и разрушает материал по двойному механизму – обезуглероживания вследствие взаимодействия водорода с углеродом
Газовая коррозия стальных конструкций может протекать вследствие не только окислительных, но и восстановительных процессов. При сильном нагреве стальных конструкций под высоким давлением в среде, содержащей водород, последний диффундирует в объем стали и разрушает материал по двойному механизму – обезуглероживания вследствие взаимодействия водорода с углеродом
Fe 3 OC + 2H 2 = 3Fe + CH 4 O
и придания стали свойств хрупкости вследствие растворения в ней водорода – «водородная хрупкость».
2.
Электрохимическая коррозия
- взаимодействие металла с коррозионной средой (раствором электролита), при котором ионизация атомов металла и восстановление окислительного компонента коррозионной среды протекают не в одном, акте и их скорости зависят от электродного потенциала металла (например, ржавление стали в морской воде).
 При контакте с воздухом на поверхности конструкции появляется тонкая пленка влаги, в которой растворяются примеси, находящиеся в воздухе, например диоксид углерода. При этом образуются растворы, способствующие электрохимической коррозии. Различные участки поверхности любого металла обладают разными потенциалами.
При контакте с воздухом на поверхности конструкции появляется тонкая пленка влаги, в которой растворяются примеси, находящиеся в воздухе, например диоксид углерода. При этом образуются растворы, способствующие электрохимической коррозии. Различные участки поверхности любого металла обладают разными потенциалами.
Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия – явление сложное, состоящее из нескольких элементарных процессов. На анодных участках протекает анодный процесс – в раствор переходят ионы металла (Ме), а избыточные электроны (е), оставаясь в металле, движутся к катодному участку. На катодных участках поверхности металла избыточные электроны поглощаются ионами, атомами или молекулами электролита (деполяризаторами), которые восстанавливаются:
е + Д → [Де],
где Д – деполяризатор; е – электрон.
Интенсивность коррозионного электрохимического процесса зависит от скорости анодной реакции, при которой ион металла переходит из кристаллической решетки в раствор электролита, и катодной, заключающейся в ассимиляции освобождающихся при анодной реакции электронов.
Возможность перехода иона металла в электролит определяется силой связи с электронами в междоузлиях кристаллической решетки. Чем сильнее связь между электронами и атомами, тем труднее переход иона металла в электролит. В электролитах имеются положительно заряженные частицы – катионы и отрицательно заряженные – анионы. Анионы и катионы присоединяют к себе молекулы воды.
Структура молекул воды обусловливает ее полярность. Между заряженными ионами и полярными молекулами воды возникает электростатическое взаимодействие, вследствие которого полярные молекулы воды определенным образом ориентируются вокруг анионов и катионов.
При переходе ионов металлов из кристаллической решетки в раствор электролита освобождается эквивалентное число электронов. Таким образом на границе «металл – электролит» образуется двойной электрический слой, в котором металл заряжен отрицательно, электролит – положительно; возникает скачок потенциала.
 Способность ионов металла переходить в раствор электролита характеризуется электродным потенциалом, который представляет собой энергетическую характеристику двойного электрического слоя.
Способность ионов металла переходить в раствор электролита характеризуется электродным потенциалом, который представляет собой энергетическую характеристику двойного электрического слоя.
Когда этот слой достигает разности потенциалов, переход ионов в раствор прекращается (наступает равновесное состояние).
Коррозионная диаграмма: К, К’ - катодные поляризационные кривые; А, A’ - анодные поляризационные кривые.
По характеру коррозионного разрушения
различают следующие виды коррозии:
1. сплошную, или общую коррозию , охватывающую всю поверхность металла, находящуюся под воздействием данной коррозионной среды. Сплошная коррозия характерна для стали, алюминия, цинковых и алюминиевых защитных покрытий в любых средах, в которых коррозионная стойкость данного материала или металла покрытия недостаточно высока.
Этот вид коррозии характеризуется относительно равномерным по всей поверхности постепенным проникновением в глубь металла, т. е. уменьшением толщины сечения элемента или толщины защитного металлического покрытия.
При коррозии в нейтральных, слабощелочных и слабокислых средах элементы конструкций покрываются видимым слоем продуктов коррозии, после механического удаления которого до чистого металла поверхность конструкций оказывается шероховатой, но без очевидных язв, точек коррозии и трещин; при коррозии в кислых (а для цинка и алюминия и в щелочных) средах видимый слой продуктов коррозии может не образоваться.
Наиболее подверженными этому виду коррозии участками, как правило, являются узкие щели, зазоры, поверхности под головками болтов, гайками, другие участки скопления пыли, влаги по той причине, что на этих участках фактическая продолжительность коррозии больше, чем на открытых поверхностях.
Сплошная коррозия бывает:
* равномерной, которая протекает с одинаковой скоростью по всей поверхности металла (например, коррозия углеродистой стали в растворах H 2 S0 4);
* неравномерной, которая протекает с неодинаковой скоростью на различных участках поверхности металла (например, коррозия углеродистой стали в морской воде);
*
избирательной,
при которой разрушается одна структурная составляющая сплава (графитизация чугуна) или один компонент сплава (обесцинкование латуней).
2. местную коррозию, охватывающую отдельные участки поверхности металла.
Местная коррозия
бывает:
* коррозия пятнами характерна для алюминия, алюминиевых и цинковых покрытий в средах, в которых их коррозионная стойкость близка к оптимальной, и лишь случайные факторы могут вызвать местное нарушение состояния устойчивости материала.
Этот вид коррозии характеризуется небольшой глубиной проникновения коррозии по сравнению с поперечными (в поверхности) размерами коррозионных поражений. Пораженные участки покрываются продуктами коррозии как и при сплошной коррозии. При выявлении этого вида коррозии необходимо установить причины и источники временных местных повышений агрессивности среды за счет попадания на поверхность конструкции жидких сред (конденсата, атмосферной влаги при протечках и т. п.), локального накопления или отложения солей, пыли и т. д.
 *
коррозия
язвами
характерна в основном для углеродистой и низкоуглеродистой стали (в меньшей степени - для алюминия, алюминиевых и цинковых покрытий) при эксплуатации конструкций в жидких средах и грунтах.
*
коррозия
язвами
характерна в основном для углеродистой и низкоуглеродистой стали (в меньшей степени - для алюминия, алюминиевых и цинковых покрытий) при эксплуатации конструкций в жидких средах и грунтах.
Язвенная коррозия низколегированной стали в атмосферных условиях чаще всего связана с неблагоприятной структурой металла, т. е. с повышенным количеством неметаллических включений, в первую очередь сульфидов с высоким содержанием марганца.
Язвенная коррозия характеризуется появлением на поверхности конструкции отдельных или множественных повреждений, глубина и поперечные размеры которых (от долей миллиметра до нескольких миллиметров) соизмеримы.
Обычно сопровождается, образованием толстых слоев продуктов коррозии, покрывающих всю поверхность металла или значительные ее участки вокруг отдельных крупных язв (характерно для коррозии незащищенных стальных конструкций в грунтах). Язвенная коррозия листовых конструкций, а также элементов конструкций из тонкостенных труб и прямоугольных элементов замкнутого сечения со временем переходит в сквозную с образованием отверстий в стенках толщиной до нескольких миллиметров.
Язвы являются острыми концентраторами напряжений и могут оказаться инициаторами зарождения усталостных трещин и хрупких разрушений. Для оценки скорости язвенной коррозии и прогнозирования ее развития в последующий период определяют средние скорости проникновения коррозии в наиболее глубоких язвах и количество язв на единицу поверхности. Эти данные в дальнейшем следует использовать при расчете несущей способности элементов конструкций.
* точечная (питтинговая) коррозия характерна для алюминиевых сплавов, в том числе анодированных, и нержавеющей стали. Низколегированная сталь подвергается коррозии этого вида крайне редко.
Практически обязательным условием развития питтинговой коррозии является воздействие хлоридов, которые могут попадать на поверхность конструкций на любой стадии, начиная от металлургического производства (травление проката) до эксплуатации (в виде солей, аэрозолей, пыли).
При обнаружении питтинговой коррозии необходимо выявить источники хлоридов и возможности исключения их воздействия на металл. Питтинговая коррозия представляет собой разрушение в виде отдельных мелких (не более 1 - 2 мм в диаметре) и глубоких (глубина больше поперечных размеров) язвочек.
*
сквозная коррозия
, которая вызывает разрушение металла насквозь (например, при точечной или язвенной коррозии листового металла);
*
нитевидная коррозия
, распространяющаяся в виде нитей преимущественно под неметаллическими защитными покрытиями (например, на углеродистой стали под пленкой лака);
*
подповерхностная коррозия
, начинающаяся с поверхности, но преимущественно распространяющейся под поверхностью металла таким образом, что разрушение и продукты коррозии оказываются сосредоточенными в некоторых областях внутри металла; подповерхностная коррозия часто вызывает вспучивание металла и его расслоение (например, образование пузырей на поверхности
недоброкачественного прокатанного листового металла при коррозии или травлении);
*
межкристаллитная коррозия
характерна для нержавеющей стали и упрочненных алюминиевых сплавов, особенно на участках сварки, и характеризуется относительно равномерным распределением множественных трещин на больших участках поверхности конструкций. Глубина трещин, обычно меньше, чем их размеры на поверхности. На каждом участке развития, этого вида коррозии трещины практически одновременно зарождаются от многих источников, связь которых с внутренними или рабочими напряжениями, не является обязательной. Под оптическим микроскопом на поперечных шлифах, изготавливаемых из отобранных проб, видно, что трещины распространяются только по границам зерен металла. Отдельные зерна и блоки могут выкрошиваться, в результате чего образуются язвы и поверхностное шелушение. Этот вид коррозии ведет к быстрой потере металлом прочности и пластичности;
*
ножевая коррозия
- локализованная коррозия металла, имеющая вид надреза ножом в зоне сплавления сварных соединений в сильно агрессивных средах (например, случаи коррозии сварных швов хромоникелевой стали Х18Н10 с повышенным содержанием углерода в крепкой HN0 3).
*
коррозионное растрескивание
— вид квазихрупкого разрушения стали и высокопрочных алюминиевых сплавов при одновременном воздействии статических напряжений растяжения и агрессивных сред; характеризуется образованием единичных и множественных трещин, связанных с концентрацией основных рабочих и внутренних напряжений. Трещины могут распространяться между кристаллами или по телу зерен, но с большей скоростью в плоскости, нормальной к действующим напряжениям, чем в плоскости поверхности.
Углеродистая и низколегированная сталь обычной и повышенной прочности подвергается этому виду коррозии в ограниченном количестве сред: горячих растворах щелочей и нитратов, смесях СО - СО 2 - Н 2 - Н 2 О и в средах, содержащих аммиак или сероводород. Коррозионное растрескивание высокопрочной стали, например высокопрочных болтов, и высокопрочных алюминиевых сплавов может развиваться в атмосферных условиях и в различных жидких средах.
При установлении факта поражения конструкции коррозионным растрескиванием необходимо убедиться в отсутствии признаков других форм квазихрупкого разрушения (хладноломкости, усталости).
* коррозионная хрупкость , приобретенная металлом в результате коррозии (например, водородное охрупчивание труб из высокопрочных сталей в условиях сероводородных нефтяных скважин); под хрупкостью следует понимать свойство материала разрушаться без заметного поглощения механической энергии в необратимой форме.
Количественная оценка коррозии. Скорость общей коррозии оценивают по убыли металла с единицы площади коррозии, например в г/м 2 ․ ч, или по скорости проникновения коррозии, т. е. по одностороннему уменьшению толщины нетронутого металла (П ), например в мм/год.
При равномерной коррозии П = 8,75К/ρ , где ρ - плотность металла в г/см 3 . При неравномерной и местной коррозии оценивается максимальное проникновение. По ГОСТу 13819-68 установлена 10-балльная шкала общей коррозионной стойкости (см. табл.). В особых случаях К. может оцениваться и по др. показателям (потеря механической прочности и пластичности, рост электрического сопротивления, уменьшение отражательной способности и т. д.), которые выбираются в соответствии с видом К. и назначением изделия или конструкции.
10-балльная шкала для оценки общей коррозионной стойкости металлов
|
Группа стойкости |
Скорость коррозии металла, мм/год. |
Балл |
|
Совершенно стойкие |
|Менее 0,001 |
1 |
|
Весьма стойкие |
Свыше 0,001 до 0,005 |
2 |
|
Свыше 0,005 до 0,01 |
3 |
|
|
Стойкие |
Свыше 0,01 до 0,05 |
4 |
|
Свыше 0,05 до 0,1 |
5 |
|
|
Пониженно-стойкие |
Свыше 0,1 до 0,5 |
6 |
|
Свыше 0,5 до 1,0 |
7 |
|
|
Малостойкие |
Свыше 1,0 до 5,0 |
8 |
|
Свыше 5,0 до 10,0 |
9 |
|
|
Нестойкие |
Свыше 10,0 |
10
|
При подборе материалов, стойких к воздействию различных агрессивных сред в тех или иных конкретных условиях, пользуются справочными таблицами коррозионной и химической стойкости материалов или проводят лабораторные и натурные (непосредственно на месте и в условиях будущего применения) коррозионные испытания образцов, а также целых полупромышленных узлов и аппаратов. Испытания в условиях, более жёстких, чем эксплуатационные, называют ускоренными.
Применение различных методов защиты металлов
от коррозии позволяет в какой-то степени свести к минимуму потери металла от коррозии. В зависимости от причин, вызывающих коррозию, различают следующие методы защиты.
1) Обработка внешней среды, в которой протекает коррозия . Сущность метода заключается либо в удалении из окружающей среды тех веществ, которые выполняют роль деполяризатора, либо в изоляции металла от деполяризатора. Например, для удаления из воды кислорода используют специальные вещества или кипячение.
Удаление кислорода из коррозионной среды называется деаэрацией . Максимально замедлить процесс коррозии можно путем введения в окружающую среду специальных веществ – ингибиторов . Широкое распространение получили летучие и парофазные ингибиторы, которые защищают от атмосферной коррозии изделия из черных и цветных металлов при хранении, транспортировке и т.д.
Ингибиторы применяются при очистке паровых котлов от накипи, для снятия окалины с отработанных деталей, а также при хранении и перевозке соляной кислоты в стальной таре. В качестве органических ингибиторов применяют тиомочевину (химическое название — сульфид-диамид углерода C(NH 2) 2 S), диэтиламин, уротропин (CH 2) 6 N 4) и другие производные аминов.
В качестве неорганических ингибиторов применяют силикаты (соединения металла с кремнием Si), нитриты (соединения с азотом N), дихроматы щелочных металлов и т.д. Механизм действия ингибиторов заключается в том, что их молекулы адсорбируются на поверхности металла, препятствуя протеканию электродных процессов.
2) Защитные покрытия
. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия
. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. Примером анодного покрытия может служить хром, нанесенный на железо.
Катодные покрытия
. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо).
Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
3) Электрохимическая защита
. Различают два вида электрохимической защиты: катодная и протекторная. В обоих случаях создаются условия для возникновения на защищаемом металле высокого электроотрицательного потенциала.
Протекторная защита
. Защищаемое от коррозии изделие соединяют с металлическим ломом из более электроотрицательного металла (протектора). Это равносильно созданию гальванического элемента, в котором протектор является анодом и будет разрушаться. Например, для защиты подземных сооружений (трубопроводов) на некотором расстоянии от них закапывают металлолом (протектор), присоединив его к сооружению.
Катодная защита
отличается от протекторной тем, что защищаемая конструкция, находящаяся в электролите (почвенная вода), присоединяется к катоду внешнего источника тока. В ту же среду помещают кусок металлолома, который соединяют с анодом внешнего источника тока. Металлический лом подвергается разрушению, предохраняя тем самым от разрушения защищаемую конструкцию.
Во многих случаях металл предохраняет от коррозии образующаяся на его поверхности стойкая оксидная пленка (так, на поверхности алюминия образуется Al 2 O 3 , препятствующий дальнейшему окислению металла). Однако некоторые ионы, например Cl – , разрушают такие пленки и тем самым усиливают коррозию.
Коррозия металлов наносит большой экономический вред. Человечество несет огромные материальные потери в результате коррозии трубопроводов, деталей машин, судов, мостов, морских конструкций и технологического оборудования.
Коррозия приводит к уменьшению надежности работы оборудования: аппаратов высокого давления, паровых котлов, мета ллических контейнеров для токсичных и радиоактивных веществ, лопастей и роторов турбин, деталей самолетов и т.д. С учетом возможной коррозии приходится завышать прочность этих изделий, а значит, увеличивать расход металла, что приводит к дополнительным экономическим затратам. Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции (утечка нефти, газов, воды), к энергетическим затратам для преодоления дополнительных сопротивлений, вызванных уменьшением проходных сечений трубопроводов из-за отложения ржавчины и других продуктов коррозии. Коррозия также приводит к загрязнению продукции, а значит, и к снижению ее качества.
Затраты на возмещение потерь, связанных с коррозией, исчисляются миллиардами рублей в год. Специалисты подсчитали, что в развитых странах стоимость потерь, связанных с коррозией, составляет 3…4% валового национального дохода.
За долгий период интенсивной работы металлургической промышленности выплавлено огромное количество металла и переведено в изделия. Этот металл постоянно корродирует. Сложилась такая ситуация, что потери металла от коррозии в мире уже составляют около 30% от его годового производства. Считается, что 10% прокорродировавшего металла теряется (в основном в виде ржавчины) безвозвратно. Возможно, в будущем установится баланс, при котором от коррозии будет теряться примерно столько же металла, сколько его будет выплавляться вновь. Из всего сказанного следует, что важнейшей проблемой является изыскание новых и совершенствование старых способов защиты от коррозии.
Список литературы
Козловский А.С. Кровельные работы. – М.: «Высшая школа», 1972
Акимов Г. В., Основы учения о коррозии и защите металлов, М., 1946;
Томашов Н. Д., Теория коррозии и защита металлов, М., 1959;
Эванс Ю. P., Коррозия и окисление металлов, пер. с англ., М., 1962;
Розенфельд И. Л., Атмосферная коррозия металлов, М., 1960;
Словосочетания «коррозия металла» заключает в себе намного больше, чем название популярной рок-группы. Коррозия безвозвратно разрушает металл , превращая его в труху: из всего, произведенного в мире железа, 10% полностью разрушится в этот же год. Ситуация с российским металлом выглядит примерно так — весь металл, выплавленный за год в каждой шестой доменной печи нашей страны, становится ржавой трухой еще до конца года.
Выражение «обходится в копеечку» в отношении коррозии металла более чем верно — ежегодный ущерб, приносимый коррозией, составляет не менее 4% годового дохода любой развитой страны, а в России сумма ущерба исчисляется десятизначной цифрой. Так что же вызывает коррозийные процессы металлов и как с ними бороться?
Что такое коррозия металлов
Разрушение металлов в результате электрохимического (растворение во влагосодержащей воздушной или водной среде — электролите) или химического (образование соединений металлов с химическими агентами высокой агрессии) взаимодействия с внешней средой. Коррозийный процесс в металлах может развиться лишь в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия).
Металл под воздействием кислорода и воды становится рыхлым светло-коричневым порошком, больше известным как ржавчина (Fе 2 O 3 ·H 2 О).
Химическая коррозия
Этот процесс происходит в средах, не являющихся проводниками электрического тока (сухие газы, органические жидкости — нефтепродукты, спирты и др.), причем интенсивность коррозии возрастает с повышением температуры — в результате на поверхности металлов образуется оксидная пленка.
Химической коррозии подвержены абсолютно все металлы — и черные, и цветные. Активные цветные металлы (например — алюминий) под воздействием коррозии покрываются оксидной пленкой, препятствующей глубокому окислению и защищающей металл. А такой мало активный металл, как медь, под воздействием влаги воздуха приобретает зеленоватый налет — патину. Причем оксидная пленка защищает металл от коррозии не во всех случаях — только если кристаллохимическая структура образовавшейся пленки сообразна строению металла, в противном случае — пленка ничем не поможет.

Сплавы подвержены другому типу коррозии: некоторые элементы сплавов не окисляются, а восстанавливаются (например, в сочетании высокой температуры и давления в сталях происходит восстановление водородом карбидов), при этом сплавы полностью утрачивают необходимые характеристики.
Электрохимическая коррозия
Процесс электрохимической коррозии не нуждается в обязательном погружении металла в электролит — достаточно тонкой электролитической пленки на его поверхности (часто электролитические растворы пропитывают среду, окружающую металл (бетон, почву и т.д.)). Наиболее распространенной причиной электрохимической коррозии является повсеместное применение бытовой и технической солей (хлориды натрия и калия) для устранения льда и снега на дорогах в зимний период — особенно страдают автомашины и подземные коммуникации (по статистике, ежегодные потери в США от использования солей в зимний период составляют 2,5 млрд. долларов).
Происходит следующее: металлы (сплавы) утрачивают часть атомов (они переходят в электролитический раствор в виде ионов), электроны, замещающие утраченные атомы, заряжают металл отрицательным зарядом, в то время как электролит имеет положительный заряд. Образуется гальваническая пара: металл разрушается, постепенно все его частицы становятся частью раствора. Электрохимическую коррозию могут вызывать блуждающие токи, возникающие при утечке из электрической цепи части тока в водные растворы или в почву и оттуда — в конструкции из металла. В тех местах, где блуждающие токи выходят из металлоконструкций обратно в воду или в почву, происходит разрушение металлов. Особенно часто блуждающие токи возникают в местах движения наземного электротранспорта (например, трамваев и ж/д локомотивов на электрической тяге). Всего за год блуждающие токи силой в 1А способны растворить железа — 9,1 кг, цинка — 10,7 кг, свинца — 33,4 кг.
Другие причины коррозии металла
Развитию коррозийных процессов способствуют радиация, продукты жизнедеятельности микроорганизмов и бактерий. Коррозия, вызываемая морскими микроорганизмами, наносит ущерб днищам морских судов, а коррозийные процессы, вызванные бактериями, даже имеют собственное название — биокоррозия.

Совокупность воздействия механических напряжений и внешней среды многократно ускоряет коррозию металлов — снижается их термоустойчивость, повреждаются поверхностные оксидные пленки, а в тех местах, где появляются неоднородности и трещины, активируется электрохимическая коррозия.
Меры защиты металлов от коррозии
Неизбежными последствиями технического прогресса является загрязнение нашей среды обитания — процесс, ускоряющий коррозию металлов, поскольку внешняя окружающая среда проявляет к ним все большую агрессию. Каких-либо способов полностью исключить коррозийное разрушение металлов не существует, все, что можно сделать, это максимально замедлить этот процесс.
Для минимизации разрушения металлов можно сделать следующее: снизить агрессию среды, окружающей металлическое изделие; повысить устойчивость металла к коррозии; исключить взаимодействие между металлом и веществами из внешней среды, проявляющими агрессию.
Человечеством за тысячи лет испробованы многие способы защиты металлических изделий от химической коррозии, некоторые из них применяются по сей день: покрытие жиром или маслом, другими металлами, коррозирующими в меньшей степени (самый древний метод, которому уже более 2 тыс. лет — лужение (покрытие оловом)).
Антикоррозийная защита неметаллическими покрытиями
Неметаллические покрытия — краски (алкидные, масляные и эмали), лаки (синтетические, битумные и дегтевые) и полимеры образуют защитную пленку на поверхности металлов, исключающую (при своей целостности) контакт с внешней средой и влагой.
Применение красок и лаков выгодно тем, что наносить эти защитные покрытия можно непосредственно на монтажной и строительной площадке. Методы нанесения лакокрасочных материалов просты и поддаются механизации, восстановить поврежденные покрытия можно «на месте» — во время эксплуатации, эти материалы имеют сравнительно низкую стоимость и их расход на единицу площади невелик. Однако их эффективность зависит от соблюдения нескольких условий: соответствие климатическим условиям, в которых будет эксплуатироваться металлическая конструкция; необходимость применения исключительно качественных лакокрасочных материалов ; неукоснительное следование технологии нанесения на металлические поверхности. Лакокрасочные материалы лучше всего наносить несколькими слоями — их количество обеспечит лучшую защиту от атмосферного воздействия на металлическую поверхность.

В роли защитных покрытий от коррозии могут выступать полимеры — эпоксидные смолы и полистирол, поливинилхлорид и полиэтилен. В строительных работах закладные детали из железобетона покрываются обмазками из смеси цемента и перхлорвинила, цемента и полистирола.
Защита железа от коррозии покрытиями из других металлов
Существует два типа металлических покрытий-ингибиторов — протекторные (покрытия цинком, алюминием и кадмием) и коррозионностойкие (покрытия серебром, медью, никелем, хромом и свинцом). Ингибиторы наносятся химическим способом: первая группа металлов имеет большую электроотрицательность по отношению к железу, вторая — большую электроположительность. Наибольшее распространение в нашем обиходе получили металлические покрытия железа оловом (белая жесть, из нее производят консервные банки) и цинком (оцинкованное железо — кровельное покрытие), получаемые путем протягивания листового железа через расплав одного из этих металлов.
Часто цинкованию подвергаются чугунная и стальная арматура, а также водопроводные трубы — эта операция существенно повышает их стойкость к коррозии, но только в холодной воде (при проводе горячей воды оцинкованные трубы изнашиваются быстрее неоцинкованных). Несмотря на эффективность цинкования, оно не дает идеальной защиты — цинковое покрытие часто содержит трещины, для устранения которых требуется предварительное никелерование металлических поверхностей (покрытие никелем). Цинковые покрытия не позволяют наносить на них лакокрасочные материалы — нет устойчивого покрытия.
Лучшее решение для антикоррозийной защиты — алюминиевое покрытие. Этот металл имеет меньший удельный вес, а значит — меньше расходуется, алюминированные поверхности можно окрашивать и слой лакокрасочного покрытия будет устойчив. Кроме того, алюминиевое покрытие по сравнению с оцинкованным покрытием обладает большей стойкостью в агрессивных средах. Алюминирование слабо распространено из-за сложности нанесения этого покрытия на металлический лист — алюминий в расплавленном состоянии проявляет высокую агрессию к другим металлам (по этой причине расплав алюминия нельзя содержать в стальной ванне). Возможно, эта проблема будет полностью решена в самое ближайшее время — оригинальный способ выполнения алюминирования найден российскими учеными. Суть разработки заключается в том, чтобы не погружать стальной лист в расплав алюминия, а поднять жидкий алюминий к стальному листу.
Повышение коррозийной стойкости путем добавления в стальные сплавы легирующих добавок
Введение в стальной сплав хрома, титана, марганца, никеля и меди позволяет получить легированную сталь с высокими антикоррозийными свойствами. Особенную стойкость стальному сплаву придает большая доля хрома, благодаря которому на поверхности конструкций образуется оксидная пленка большой плотности. Введение в состав низколегированных и углеродистых сталей меди (от 0,2% до 0,5%) позволяет повысить их коррозийную устойчивость в 1,5-2 раза. Легирующие добавки вводятся в состав стали с соблюдением правила Таммана: высокая коррозийная устойчивость достигается, когда на восемь атомов железа приходится один атом легирующего металла.
Меры противодействия электрохимической коррозии
Для ее снижения необходимо понизить коррозийную активность среды посредством введения неметаллических ингибиторов и уменьшить количество компонентов, способных начать электрохимическую реакцию. Таким способом будет понижение кислотности почв и водных растворов, контактирующих с металлами. Для снижения коррозии железа (его сплавов), а также латуни, меди, свинца и цинка из водных растворов необходимо удалить диоксид углерода и кислород. В электроэнергетической отрасли проводится удаление из воды хлоридов, способных повлиять на локальную коррозию. С помощью известкования почвы можно снизить ее кислотность.
Защита от блуждающих токов
Снизить электрокоррозию подземных коммуникаций и заглубленных металлоконструкций возможно при соблюдении нескольких правил:
- участок конструкции, служащий источником блуждающего тока, необходимо соединить металлическим проводником с рельсом трамвайной дороги;
- трассы теплосетей должны размещаться на максимальном удалении от рельсовых дорог, по которым передвигается электротранспорт, свести к минимуму число их пересечений;
- применение электроизоляционных трубных опор для повышения переходного сопротивления между грунтом и трубопроводами;
- на вводах к объектам (потенциальным источникам блуждающих токов) необходима установка изолирующих фланцев;
- на фланцевой арматуре и сальниковых компенсаторах устанавливать токопроводящие продольные перемычки — для наращивания продольной электропроводимости на защищаемом отрезке трубопроводов;
- чтобы выровнять потенциалы трубопроводов, расположенных параллельно, необходимо установить поперечные электроперемычки на смежных участках.
Защита металлических объектов, снабженных изоляцией, а также стальных конструкций небольшого размера выполняется с помощью протектора, выполняющего функцию анода. Материалом для протектора служит один из активных металлов (цинк, магний, алюминий и их сплавы) — он принимает на себя большую часть электрохимической коррозии, разрушаясь и сохраняя главную конструкцию. Один анод из магния, к примеру, обеспечивает защиту 8 км трубопровода.
Абдюжанов Рустам, специально для рмнт.ру
Лекция 9. Коррозия металлов.
План лекции
1. Коррозия металлов.
2. Химическая и электрохимическая коррозия. Механизм коррозии. Факторы, определяющие интенсивность коррозии.
3. Виды электрохимической коррозии.
4. Методы защиты металлов от коррозии - покрытия.
5. Электрохимические методы защиты. Ингибиторы коррозии.
Задачи изучения темы:
В процессе освоения темы студенты получают представление о процессе коррозии, его механизме, факторах, влияющих на коррозионный процесс. Способы защиты металлов от коррозии.
Студент должен знать:
Природу коррозионных процессов. Основные способы защиты металлов от коррозии, их классификация и механизм действия.
Основная и дополнительная литература
Основная
1. Глинка Н.Л. Общая химия: Учебное пособие для вузов / Под ред. А.И. Ермакова. – изд. 28-е, перераб. и доп. – М.: Интеграл-Пресс, 2000. – С. 27-36.
2. Ахметов Н.С. Общая и неорганическая химия. М: Высш.шк., 2005. 743 с.
3. Угай Я.А. Общая и неорганическая химия. М: Высш.шк, 2004. 527 с.
4. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов / под ред. В.А. Рабиновича и др. М.: Интеграл-Пресс, 1997. – 240 с.
Дополнительная
5. Некрасов Б.В. Основы общей химии. СПб-М: Высш.шк, 2003 Т. 1, 2.
6. Коровин Н.В. Общая химия. М: Высш.шк., 2005. 557 с.
7. Практикум по общей и неорганической химии: Пособие для студентов вузов. / В.И. Фионов, Т.М. Курохтина, З.Н. Дымова и др.; Под ред. Н.Н. Павлова, В.И. Фролова. – 2-е изд., перераб. и доп. – М.: Дрофа, 2002. – С. 33-47.
Методические разработки кафедры
8. Гаркушин И.К., Лисов Н.И., Немков А.В. Общая химия для технических вузов. Учебное пособие. Самарск. гос. техн. ун-т, Самара. – 2003. – С. 144-166.
9. Жиляева И.И., Громаковская А.Г. Коррозия металлов. Метод. указания к лабораторной работе.
1. КОРРОЗИЯ Corrodere (лат.) – разъедать.
Коррозия это разрушение металла и изделий из-за химического взаимодействия с окружающей средой.
Коррозия - окислительно-восстановительный гетерогенный процесс, протекающий на поверхности раздела фаз – металл/жидкость, металл/газ. Это самопроизвольный процесс, приводящий к получению термодинамически более устойчивых соединений.
Ежегодные потери металла из-за коррозии составляют 10 – 12% производственных мировых запасов.
Основные виды коррозии разделяют :
По механизму протекания коррозии:
Химическая – протекает в неэлектролитах – гетерогенное взаимодействие металла с окислителем окружающей среды (газовая, неэлектролитная);
Электрохимическая – протекает в электролитах – взаимодействие металла с окислителем включает анодное растворение металла и катодное восстановление окислителя (электролитная, влажно-атмосферная, почвенная)
По характеру разрушения поверхности металла :
Равномерная (общая) – распределяется более или менее равномерно по всей поверхности металла;
Местная – пятнами (язвами);
Точечная (на поверхности) или питтинг (на большой глубине);
Межкристаллитная – по границам зерен (самая опасная – ослабевают связи между зернами структуры сплава);
Подповерхностная – незаметная (под поверхностью металла);
Избирательная – растворение одного из компонентов сплава;
Растрескивание – при одновременном воздействии химических реагентов и высоких механических напряжений;
Селективная – избирательная.
Рассмотрим более подробно химическую и электрохимическую коррозии:
2. ХИМИЧЕСКАЯ КОРРОЗИЯ
Сущность химической коррозии – в окислении металла в результате химического взаимодействия его с окружающей средой.
Среды вызывающие химическое разрушение металла называются агрессивными.
Химическая коррозия осуществляется путем непосредственной передачи электрона от атома металла к атому окислителя.
Химическую коррозию подразделяют на газовую и неэлектролитную (жидкостная неэлектролитная коррозия).
Жидкостная неэлектролитная коррозия развивается при эксплуатации химического оборудования, соприкосновения с нефтью и ее продуктами, жидким бромом, бензином, керосином и др. органикой, т.е. веществами, не проводящими электрический ток.
Коррозия в газах (газовая коррозия наиболее распространенная) происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т.п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др. (так например диоксид серы присутствующий в заводских помещениях под действием температуры окисляется образую триоксид серы, который вступает а реакцию с металлом, тем самым разрушая ее)
С повышением температуры скорость газовой коррозии возрастает.
Частный случай газовой коррозии – водородная коррозия (водород связывает углерод находящийся в стали в непредельные углеводороды – метан и т.д.)
Fe 3 C (цементит) + 2H 2 3Fe + CH 4
Карбонильная – Me + nCO Me(CO)n
Чистые металлы в большинстве случаев почти не подвергаются коррозии. Даже такой металл, как железо, в совершенно чистом виде не ржавеет. Но обыкновенные металлы всегда содержат различные примеси, что создает благоприятные условия для коррозии.
На ряде металлов образуется тонкий слой оксида.
В качестве примера на рисунке показано образование оксидов на поверхности металла:
Если пленка прочно связана с поверхностью металла и не имеет механических повреждений, то она защищает металл от дальнейшего окисления. Такие защитные пленки имеются у алюминия, хрома, цинка, марганца, титана, ванадия, никеля и кобальта. Для того чтобы оксидная пленка защищала металл, она должна быть сплошной, обладать высокой адгезией, быть устойчивой к агрессивным средам, обладать коэффициентом термического расширения близким к этому показателю металла.
У железа она пористая, легко отделяется от поверхности и поэтому не способна защитить металл от разрушения.
Для изготовления аппаратуры, подвергающейся действию коррозионно-активных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, никель, алюминий; применяются также сплавы на основе никеля или кобальта.
ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Электрохимическая коррозия возникает при контакте двух разнородных металлов (или примеси неметаллов) в среде электролита.
В отличие от химической коррозии, передача электронов идет через токопроводящую среду – электролит. Коррозия протекает в местах контактов металлов, имеющих разные электродные потенциалы, которые выполняют роль электродов.
Во всех случаях различной неоднородности на поверхности металла самопроизвольно возникают локальные микрогальванические элементы – гальванопары.
При гальванокоррозии поток электронов направлен от более активного металла к менее и более активный металл разрушается. При возникновении гальвано пары появляется ток тем большей силы, чем дальше отстоят металлы в ряду напряжений.
Скорость электрохимической коррозии зависит от природы металла, природы электролита и температуры.
Скорость коррозии металла повышается также при включении в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков, в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла и также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствует образованию на ней защитных слоев.
Виды электрохимической коррозии
Наиболее характерные виды электрохимической коррозии:
Атмосферная – протекает во влажном воздухе при обычной температуре. Поверхность металла покрывается пленкой влаги, содержащей растворенный кислород. Интенсивность коррозии возрастает с увеличением влажности воздуха, содержания в нем газообразных СО 2 и SO 2 , пыли, копоти, а также при наличии на поверхности металла шероховатостей и трещин, облегчающих конденсацию влаги.
Различают: сухую атмосферную коррозию, протекающую при относительной влажности 60%, под действием кислорода, и мокрую атм. коррозию – разрушение металлических конструкций под действием дождя, снега и туманов.
Почвенная – металлы соприкасаются с влагой почвы, содержащей растворенный кислород. Анодному разрушению подвергаются участки с большей увлажненностью и меньшим доступом воздуха. Особенно коррозионно-активны почвы с высокой влажностью, кислотностью и электрической проводимостью. Поэтому на скорость газовой коррозии влияют следующие характеристики – пористость, рН, электропроводность, наличие растворенных солей.
В таких условиях трубопроводы разрушаются в течение полугода после их укладки, если не принимаются специальные меры для из защиты.
Морская коррозия – это коррозия в морской воде, агрессивность которой обусловлена содержанием кислорода и наличием в ней хлоридов металлов, препятствующих образованию эффективных защитных пленок. Наиболее сильно она протекает на границы воды и атмосферы.
Электрокоррозия – происходит под действием блуждающих токов, возникающих от посторонних источников (линии электропередач, электрические железные дороги, различные электроустановки, работающие на постоянном электрическом токе) от которых через недостаточную электроизоляцию ток может истекать в грунт. Блуждающий ток, попав на находящийся в земле металлический предмет, в некотором месте выходит в грунт, вызывая разрушение места выхода – которое называется анодным выходом, где наблюдается очень интенсивная коррозия. Блуждающие токи вызывают коррозию газопроводов, нефтепроводов, электрокабелей, различных подземных металлических сооружений.
4. МЕТОДЫ БОРЬБЫ С КОРРОЗИЕЙ
Изоляция металлов от агрессивной среды (ПОКРЫТИЯ) :
Металлические покрытия – покрытие защищаемого металла слоем другого металла, практически не корродирующего в тех же условиях.
При покрытии изделия различными металлами надо помнить, что покрытие и защищаемый металл могут образовывать гальваническую пару. Ее работа в определенных условиях может либо усиливать защитное действие, либо наоборот усиливать коррозию защищаемого металла.
Анодное покрытие . Например при локальном нарушении цинкого покрытия в гальвано паре цинк–железо анодом будет цинк, который и будет разрушаться, защищая железо.
Катодное покрытие . А в паре олово–железо при нарушении оловянного покрытия разрушению будет подвергаться железо, т.к. в этой паре именно оно является анодом.
Различия коррозиционной стойкости покрытий в тех или иных агрессивных средах и свойства конечных продуктов коррозии определяют специфические области применения этих покрытий.
Неметаллические покрытия – пленки высокополимерных веществ (каучуки, пластмассы), лаки, олифа, композиции из высокополимерных и неорганических красящих веществ.
Покрытие резиной называется – гуммирование, а бетоном – торкретирование
90% всех металлических изделий защищают подобным образом. Дешевы, их просто наносить, но они не прочны.
Химические покрытия(более надежны):
пленки из оксидов металлов (толщиной 0,3 микрона), получаемые при действии кислорода или подходящих окислителей (HNO 3 , K 2 Cr 2 O 7 и др.) на поверхность металлов. Часто такие оксидные пленки образуются на поверхности металлов просто при соприкосновении с воздухом, что делает химически сравнительно активные металлы (Zn, Al) практически коррозионно-стойкими;
подобную же роль могут играть защитные нитридные пленки, образующиеся при действии азота или аммиака на поверхность некоторых металлов;
искусственное оксидирование (толщиной до 30 микрон), азотирование и фосфатирование, причем лакокрасочные покрытия наносятся на оксидированный, азотированный и фосфатированный металл.
Так оксидирование железа (выроненная сталь) проводят в смеси гидроксида натрия (800г/л) с нитратом (50г/л) и нитритом (200г/л) натрия при температуре 140 о С.
Оксидирование железа приводит к формированию на его поверхности пленок Fe 3 O 4 – черного цвета или Fe 2 O 3 – коричневого цвета.
А для фосфатирования применяют фосфаты марганца и железа, которые приводят к формированию трудно растворимых пленок трехвалентного железа.
Фосфатные и оксидные пленки нередко используют как электроизоляционные покрытия, например на трансформаторных пластинах (пробивное напряжение таких пленок может достигать 600 В).
5. Электрохимические методы защиты – основаны на изменении потенциала защищаемого металла и не связаны с изоляцией металла от коррозионной среды.
катодная (электрозащита) – защищаемая конструкция, находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду внешнего источника электричества (к отрицательному полюсу). В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединенный к аноду внешнего источника электричества. Фактически он служит источником электронов, поставляемых на катод. В процессе коррозии этот кусок старого металла разрушается.
| Катодная защита |
 |
протекторная (анодная) – используется специальный анод – протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (Zn, Mg). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии разрушается протектор.
Этот метод применяется для защиты от коррозии лопастей турбин подводных частей кораблей, для защиты холодильного оборудования, работающего с солевыми продуктами.
Воздействие на агрессивную среду
Для замедления коррозии металлических изделий в агрессивную среду вводят вещества (чаще всего органические), называемые ингибиторами коррозии, которые пассивируют поверхность металла и препятствуют развитию коррозионных процессов. Это имеет большое значение в тех случаях, когда металл необходимо защищать от разъедания кислотами. Ингибиторы коррозии широко применяют при химической очистке паровых котлов от накипи, для снятия окалины с отработанных изделий, а также при хранении и перевозке HCl в стальной таре. В качестве органических ингибиторов коррозии применяют тиомочевину (сульфид-диамид углерода C(NH 2) 2 S), диэтиламин, уротропин (гексаметилентетрамин (CH 2) 6 N 4) и другие производные аминов, а в качестве неорганических – силикаты, нитриты, дихроматы щелочных металлов и др.
К этой же группе методов защиты металлов от коррозии относится также освобождение воды, идущей на питание паровых котлов, от растворенного в ней кислорода, что достигается, например, при фильтровании воды через слой железных стружек.
Трудовые отношения

Должностная инструкция главного инженера, должностные обязанности главного инженера, образец должностной инструкции главного инженера Должностная инструкция главного инженера рэс
Открытие бизнеса

Где можно и где нельзя работать после туберкулеза Где можно работать после
Форекс